单核苷酸多态性(Single Nucleotide Polymorphisms, SNP)主要是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性,包括碱基的颠换、转换、插入和缺失。它是人类可遗传变异中最常见的一种,占所有已知多态性的90%以上。SNP作为第三代分子标记,被广泛应用于分子遗传学、法医物证检验以及疾病诊断和治疗等众多领域。
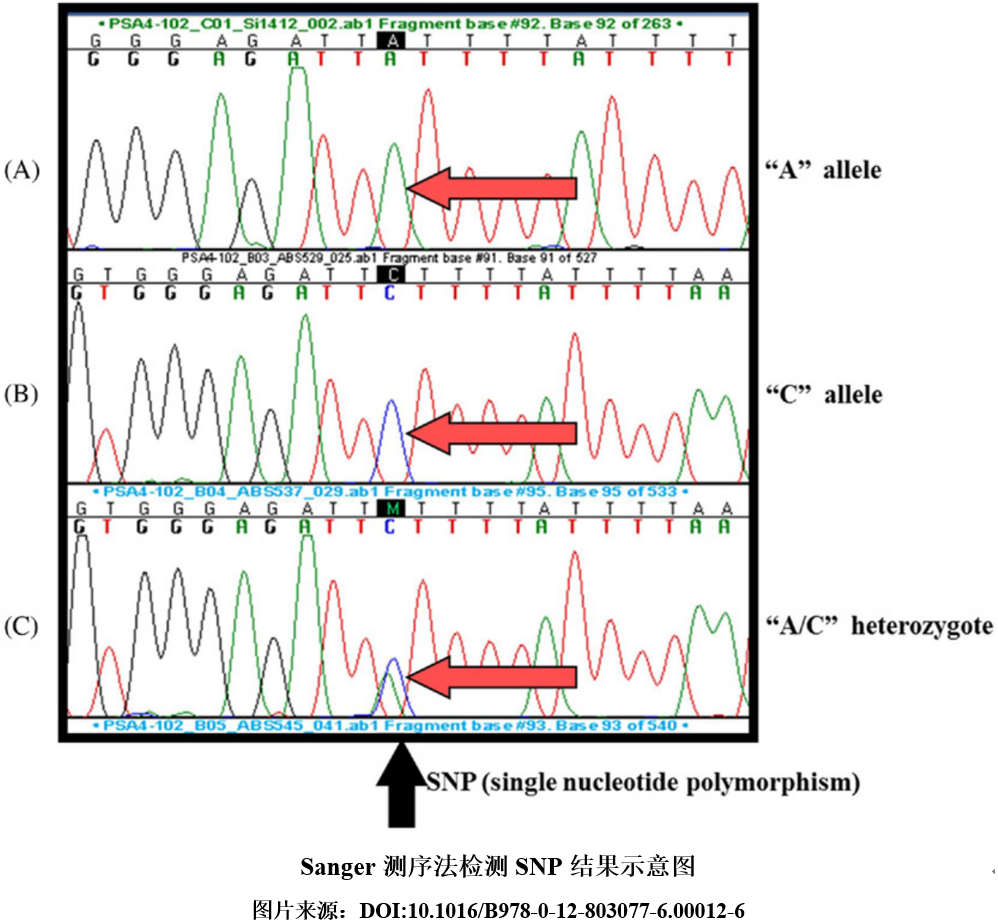
一、检测方法介绍 Sanger测序是DNA序列分析的经典方法,可直接获取核酸序列信息,是SNP检测的“金标准”。而且,Sanger测序可发现未知的 SNP位点,确定SNP 的突变类型和突变位置,是一种无法替代的最直接、最准确的SNP检测方法。采用测序法检测SNP时,首先可将含有SNP位点的靶标序列通过PCR扩增形成DNA片段后,再利用Sanger测序获取目标区域的核酸序列,并对SNP位点进行比对,由此即可确定是否存在变异位点。Sanger测序是基于双脱氧核糖核苷酸(ddNTP)末端终止的方法进行检测的。即在四个单独的反应体系中,分别对应掺入四种带有不同颜色标记的A、T、G、C双脱氧核苷酸,使得核苷酸在某一固定点开始延伸反应,而延伸过程中若掺入ddNTP,则由于碱基上无3’-OH导至延伸无法继续,从而随机在某一特定碱基处终止,形成相差一个碱基的不同系列长度的核酸片段,再利用毛细管电泳分离这些不同长度的核酸片段,最后通过不同碱基标记的颜色读取待测核酸的碱基序列,由此获得目标区域的核苷酸序列。

2、TaqMan探针法 TaqMan探针是一种双标记、自淬灭的水解探针,其5’和3’末端分别标记荧光基团和淬灭基团,在探针结构完整时两者距离较近,荧光基团的信号可被淬灭。而在PCR扩增过程中,若TaqMan探针与靶标序列完全匹配,探针则可结合在DNA模板上,此时Taq酶延伸至探针位置时,其外切酶活性将切割水解探针,释放荧光基团,使得荧光信号增强。而且,随着扩增产物的增多,荧光信号越来越强,从而可通过仪器实时监测荧光信号的变化过程。
针对双等位基因SNP,可分别设计两种对应的探针,只有探针与模板完全匹配时,在扩增扩增过程中探针可被水解产生较强的荧光信号,而如果探针与靶序列之间存在错配,其荧光强度将会减弱,由此可通过荧光强度检测SNP位点。
而由于MGB探针的长度可以设计得更短,有利于提高探针的识别特异性,因此用于检测SNP的TaqMan探针常用MGB修饰。但在测试时,需筛选测试较多的探针,探针合成成本相对较高。

扩增阻滞突变系统PCR(Amplification Refractory Mutation System PCR,ARMS-PCR),又称为等位基因特异性PCR(Allele-Specific PCR, AS-PCR),是基于Taq DNA 聚合酶无法修复引物3’末端的单个碱基错配,从而使得扩增受阻的检测方法。在扩增过程中,只有当引物3’末端的碱基与SNP位点的等位基因互补配对时,才能正常延伸扩增;而当引物3’末端的碱基与SNP位点的等位基因不互补配对时,则不发生扩增反应,由此对扩增产物进行凝胶电泳或荧光PCR检测,则可确定SNP基因型。在ARMS-PCR基础上也发展出了一些改良方法,如四引物扩增阻滞突变系统 PCR(tetra-primer amplification refractory mutation system PCR, Tetra-primer ARMS-PCR)。该方法设计了四条引物,其中两条为3’末端位于SNP位点上的内引物,两条引物方向相反,且分属于不同基因型;另外两条为通用外引物,且两条引物与SNP位点的距离应不一样。这样,在反应过程中,若四条引物均与模板完全匹配,则可扩增出三种长度不一的产物(两条内引物位于同一位点上,无长片段扩增产物形成);而如果两条内引物中有一条引物与模板不匹配,则只形成两种不同长度的产物,因此,根据电泳后产物大小即可判断基因型。然而,由于凝胶电泳检测时间较长,而且开盖进行产物分析易造成污染,因此市面上使用ARMS-PCR方法开发的产品,大部分采用了闭管检测的实时荧光PCR。ARMS-PCR法的荧光PCR检测时,同样使用TaqMan探针,只是将SNP位点设计在引物3’末端,因此理论上只有引物3’端与模板完全匹配时,才能形成扩增曲线;但在实际检测时,单个碱基的错配依然可以延伸扩增,只是效率较低。为了提高其特异性,有时需在靠近引物3’末端的位置人为引入错配碱基,以降低非靶标序列的扩增效率。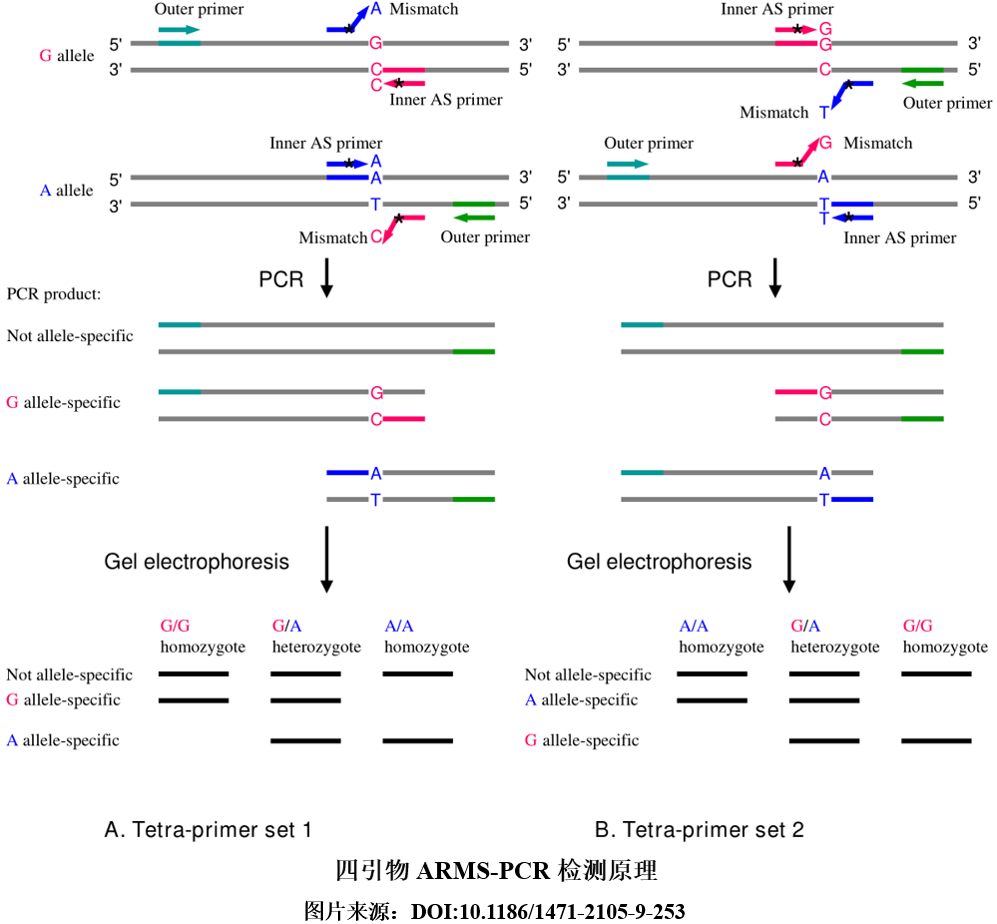
4、分子信标法 分子信标是一段双标记的寡核苷酸探针,其5’末端和3’末端分别标记荧光基团和淬灭基团,且探针5’端和3’端的部分碱基可互补配对,从而形成茎环结构,使得荧光基团和淬灭基团相互靠近而荧光信号较低。分子信标的环状结构部分包含SNP检测位点,当模板与分子信标环状结构的核酸序列完全匹配时,分子信标可与模板杂交形成伸展状态,从而导至荧光基团和淬灭基团的空间距离拉大,荧光信号增强,因此可被仪器检测,并确定SNP位点。
而使用不同荧光基团标记分子信标,则可区分SNP类型。该方法与TaqMan探针法类似,均是通过探针中单个碱基的识别能力区分SNP。只是分子信标采用茎环结构,而TaqMan探针使用MGB修饰,以提高探针对SNP的识别特异性。 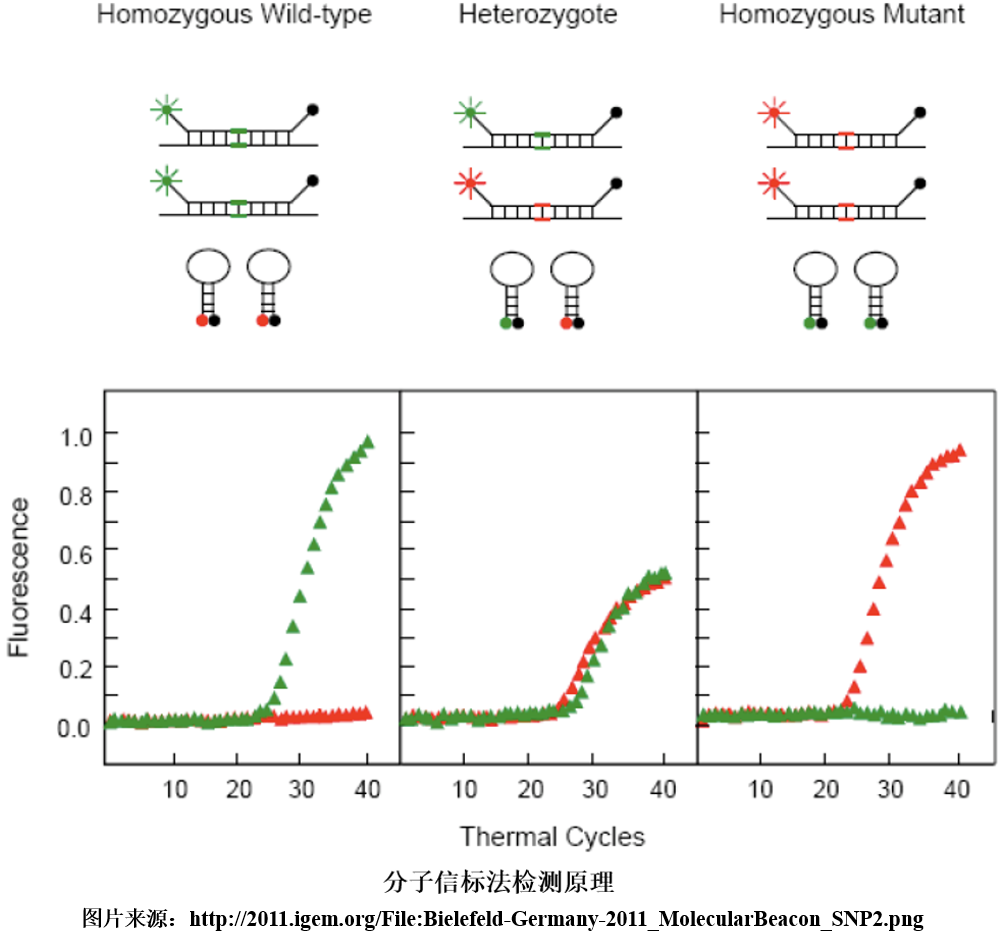
5、高分辨率熔解曲法 高分辨熔解曲线分析技术(high-resolution melting analysis, HRM)是通过特定染料与扩增后产物结合后形成特定的熔解峰进行分析检测的方法,其使用的特料为饱和荧光染料,具有更强的DNA结合能力,且不影响PCR扩增,在DNA解链过程中也不会发生重排,使得熔解曲线具有更高的分辨率。
核酸片段的固有特性,如DNA序列的长度、GC含量和碱基互补性差异等,均能影响高分辨率熔解曲线,而结合高精度荧光定量PCR仪,其分辨精度则可达到对单个碱基差异的区分,从而可用于确定SNP位点。 
6、CAPS法 酶切扩增多态性序列(Cleaved Amplified Polymorphic Sequence, CAPS),又称限制性片段长度多态性聚合酶链反应(PCR-RFLP),是PCR技术与RFLP技术相结合的检测方法。该方法基于DNA片段在酶切位点上的碱基变异,采用相应的限制性内切酶,对该DNA片段的PCR扩增产物进行酶切,从而产生不同的电泳图谱,由此确定SNP位点的碱基类型。
CAPS仅能检测位于酶切位点处的SNP,对于酶切位点以外的SNP则无法检测。为了解决这个不足,对于那些不能采用CAPS检测的SNP位点,可以使用衍生酶切扩增多态性序列(derived cleaved amplified polymorphic sequence, dCAPS)进行检测,即通过在引物上引入错配碱基创造酶切位点,进而实现多态性检测。 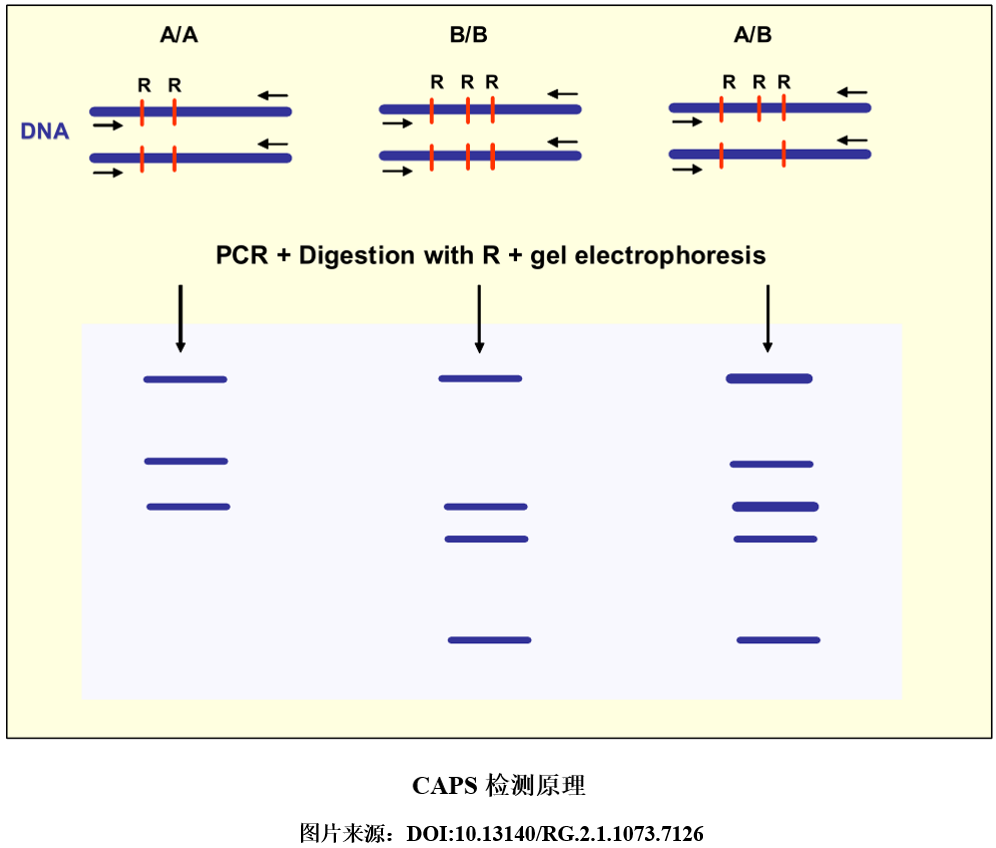
SNaPshot是美国应用生物公司(ABI)开发的一种商业技术,是基于荧光标记的单碱基延伸原理,而建立起来的分型技术,该方法也被称为小测序。其引物设计的关键是延伸引物的3’末端应紧挨着SNP位点,同时对不同SNP位点可设计不同长度的延伸引物,这样便可通过引物长度区分SNP位点。
检测时,在一个含有测序酶和四种荧光标记的ddNTP体系中进行多重PCR扩增,由于加入的核苷酸为双脱氧核糖核苷酸,因此引物延伸一个碱基即终止,其延伸产物通过测序仪检测,根据峰移动的位置可确定延伸产物对应的SNP位点,而根据峰的颜色则可确定SNP位点的碱基种类。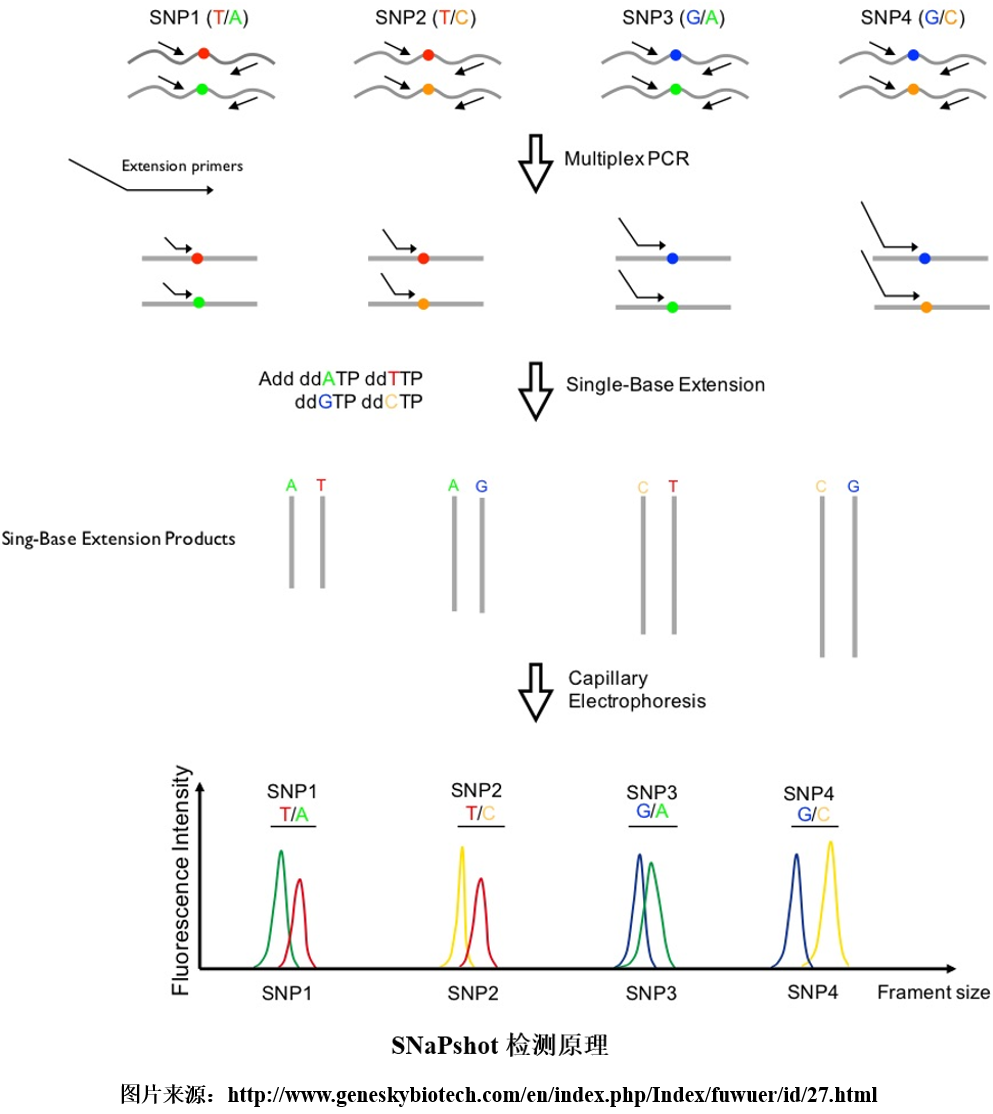
KASP(Kompetitive Allele-Specific PCR)是基于引物末端碱基的特异性匹配对SNP进行检测的方法,该方法在引物和探针设计上与常规荧光PCR不同,首先需针对SNP的等位基因设计两条对应的上游引物,引物3’末端分别位于各自的SNP位点上,同时引物5’端各自带有一段独特的标签序列,而下游引物则是一条常规设计共用的引物;其次,设计两条与上游引物标签序列一致的荧光探针,探针的5’端分别标记不同的荧光基团,同时对应于荧光探针设计各自互补配对的淬灭探针,并在淬灭探针的3’端标记淬灭基团。由此,在扩增未开始时,荧光探针与淬灭探针结合,荧光基团与淬灭基团相互靠近,而无法产生荧光信号。当设计的上游引物中有一条或两条与模板完全匹配时,则可启动扩增,其扩增产物再结合下游引物进行扩增,则形成含有标签序列的DNA片段;该带有标签序列的DNA片段可与荧光探针结合,而荧光探针3’端可作为引物启动扩增,最后形成带有荧光标记的扩增产物,而且荧光探针对应的淬灭探针则在扩增过程中被切割掉,从而使得扩增过程的荧光信号增强,可对SNP位点进行检测。KASP法针对上游引物标签序列合成了两个通用荧光探针和两个通用淬灭探针,再结合不同SNP位点的特异性引物,则可对多个SNP位点进行检测。
9、基因芯片法 基因芯片(gene chip)是指将大量针对SNP的寡核苷酸探针高密度地固定在一固相支持物表面,从而形成多重寡核苷酸微阵列,而经荧光染料标记后的待测DNA片段,与芯片上固定好的探针阵列进行杂交反应,核酸片段只与其序列完全互补配对的探针杂交,不与含有单个错配碱基的序列杂交,从而将目标序列固定下来,再通过清洗去除非目标片段,最后通过扫描检测芯片上的荧光信号,由此确定SNP位点。
另外,也可将寡核苷酸引物的5’末端固定在固相支持物上, 而让其3’末端作为引物进行延伸反应,且反应体系中使用ddNTP作为原料,因此只能延伸1个碱基, 这个被延伸的碱基与SNP位点碱基互补结合, 由此可通过检测芯片上的荧光信号确定SNP位点。
基因芯片法的检测通量高,可实现自动化,市面上已有多家企业可销售SNP芯片,如ThermoFisher、Illumina和Agilent。 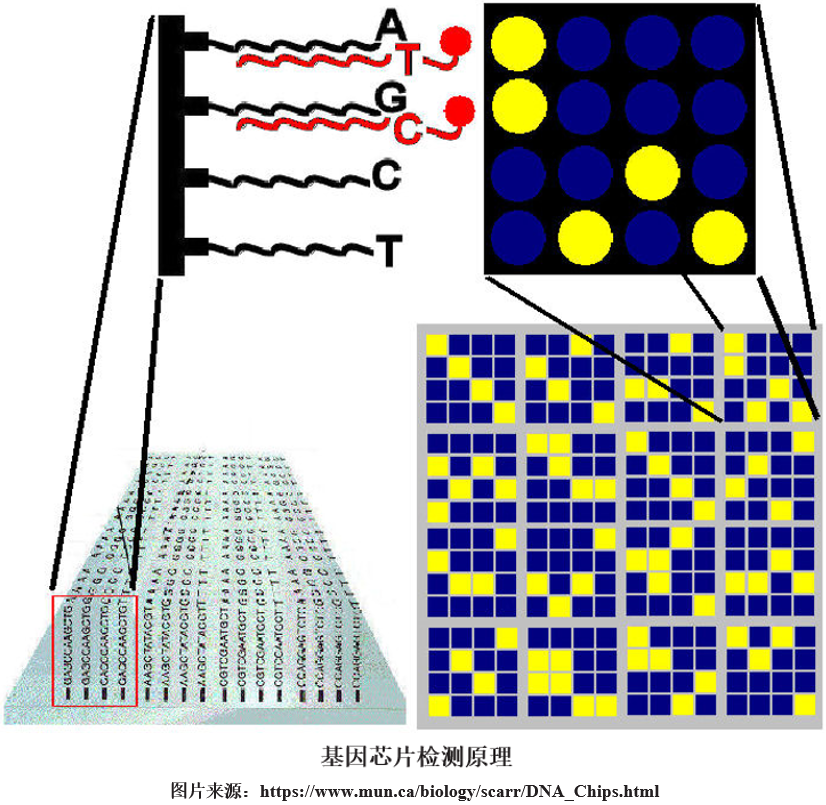
10、质谱法 质谱法是基于基质辅助激光解吸电离飞行时间质谱技术(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry, MALDI-TOF MS)的检测方法,其检测过程中,需通过激光激发DNA分子片段, 再利用飞行时间判断DNA片段的分子量大小,从而确定SNP位点。
其检测原理同样使用了单碱基延伸技术,在多重PCR扩增时,其扩增产物将在SNP位点上终止延伸,形成不同分子量的检测产物,再利用质谱分析获得图谱,而不同分子量的延伸产物,在其对应的分子量位置上可查看检测峰图,由此确定SNP位点。 
二、总结 用于检测SNP的方法,除了测序法可直接获取核酸信息外,其它方法均是基于已知SNP位点进行设计的检测方法。这些方法中,有些技术在扩增检测原理上类似。如TaqMan探针法和分子信标法均是基于探针的特异性识别来区分检测SNP位点的,ARMS-PCR和KASP则是基于引物特异性识别SNP位点的检测方法,SNaPshot法和质谱法则均使用了单碱基延伸技术。SNP检测在遗传疾病的诊断和筛查以及用药种类和剂量指导等方面有着重要的应用价值。而2019年出现的新型冠状病毒,作为一种RNA病毒,其在进化演变过程中,也出现了很多SNP位点,其中的一些变异甚至使得新冠的传染性和毒力存在进一步增强的潜在风险,因而时不时拉响了全球疫情警报。从Alpha、Beta、Mamma到后来的Delta,再到现在的Omicron,面对这些需要关注的变异株(Variants of Concern, VOC),SNP检测方法同样必不可少。
参考资料 [1]YouFM, Huo N, Gu YQ, et al. BatchPrimer3: a high throughput web application forPCR and sequencing primer design. BMC Bioinformatics. 2008 May 29;9.[2]SiyadatP, Ayatollahi H, Barati M, et al. High Resolution Melting Analysis forEvaluation of mir-612 (Rs12803915) Genetic Variant with Susceptibility toPediatric Acute Lymphoblastic Leukemia. Rep Biochem Mol Biol. 2021 Jan;9(4). |  /3
/3 